Mecanismos moleculares implicados en la adquisición y liberación del hierro por pioverdinas
Las cepas de P. aeruginosa producen pioverdina como el principal tipo de sideróforo para acceder al hierro, que es un nutriente esencial para el crecimiento bacteriano y la expresión de factores de virulencia (exotoxina A, endoproteasa PrpL). La pioverdina (PVDI) es sintetizada por péptidos sintetasas no ribosomales (NRPS) en el citoplasma bacteriano, madura en el periplasma y es secretada al medio extracelular por la bomba de eflujo dependiente de ATP PvdRT-OpmQ.
Previos estudios han dado seguimiento a la internalización de la pioverdina con el ión férrico a través de las membranas celulares; sin embargo, queda poco claro el procesamiento de este complejo ferrrisideróforo en el espacio periplásmico que permite el transporte y aprovechamiento del ión metálico para regular los diversos procesos celulares, incluso es en menor medida lo que se conoce del destino del apo-sideróforo una vez internalizado el hierro. Por ello, Bonneau y su equipo investigaron la red de interacción de las proteínas encargadas de la liberación del hierro de la PVDI en el periplasma bacteriano.
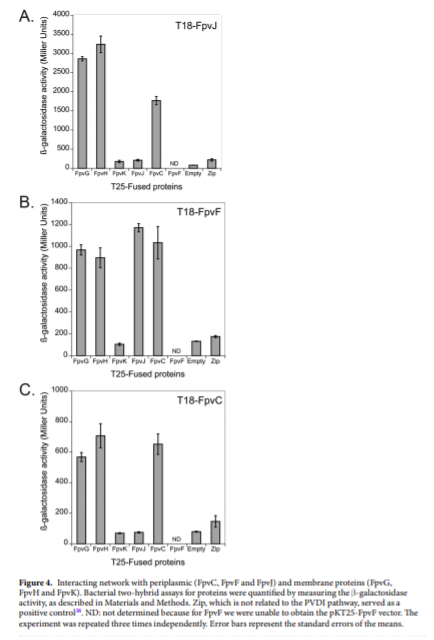
El grupo de trabajo se centró en estudiar las proteínas FpvGHJKCDEF, anteriormente reconocidas por estar involucradas en la adquisición y liberación del hierro unido a la pioverdina, probó la capacidad de cada proteína de interactuar con las demás, así como la posibilidad de formar complejos. Los complejos proteicos fueron confirmados con experimentos de purificación y extracción. Adicionalmente, se confirmó la localización celular de la proteínas.
Este trabajo descifra esencialmente una red de cinco proteínas que interactúan, tres proteínas periplásmicas que son FpvJ (función desconocida), FpvC (proteína de unión periplásmica a hierro) y FpvF (proteína de unión periplásmica a PVDI) e interactúan con el complejo de proteínas de la membrana interna FpvG (reductasa)-FpvH (función desconocida) en ausencia o presencia de PVDI-Fe. Así se logra la reducción del hierro y la transferencia de hierro ferroso de PVDI a FpvC. FpvF es capaz de interactuar con PvdT, la proteína de la membrana interna de la bomba de eflujo PvdRT-OpmQ, lo que permite el reciclaje de apo-PVDI al medio extracelular y la capacidad de quelar nuevamente Fe3 +.

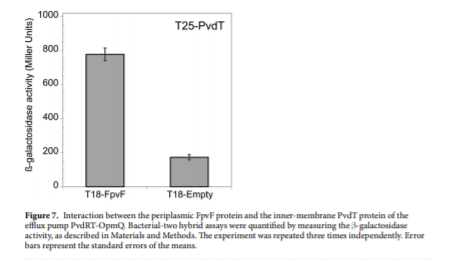
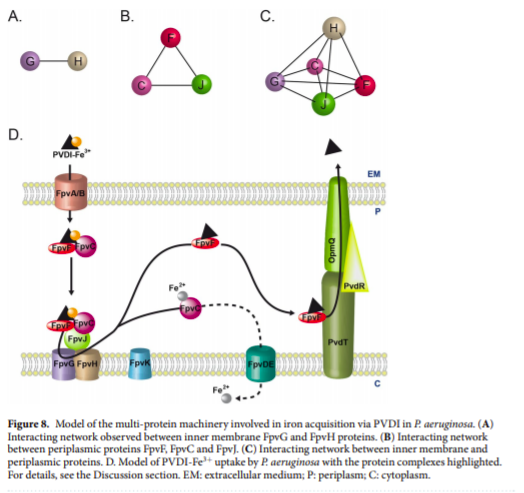
- Bonneau, A., Roche, B., & Schalk, I. J. (2020). Iron acquisition in Pseudomonas aeruginosa by the siderophore pyoverdine: an intricate interacting network including periplasmic and membrane proteins. Scientific Reports, 10(1), 1-11.